为符合国际医疗法规与标准,导入医疗器械唯一标识系统(Unique Device Identification,UDI )对医疗器械厂商来说,是目前最重要也最紧急的任务。从UDI条码的生成、标签打印与包装、到后续的数据管理等,所有项目环环相扣、缺一不可,更是横跨各部门、各专业的庞大工程。本文将针对导入UDI流程进行详尽说明,并提供有助于优化此流程的解方。
一、导入UDI常见流程
建立和导入UDI是一个漫长的过程。首先,导入过程须符合质量管理系统/ISO13485标准,撰写相关二、三、四阶建议文件。
确认好执行方向后,企业一般需依序完成以下步骤:
- 选择发码机构:依企业实际情况选择,目前三大发码机构为GS1、HIBCC 和ICCBBA。
- 创建产品标识(DI):依发码机构的标准创建,并确定该产品生产标识(PI)的组成。
- 申请医疗器械注册:注册、注册变更或办理备案,注册人/备案人应当在注册/备案管理系统中提交产品标识(DI)。
- 选择数据载体*:对医疗器械最小销售单元和更高级别的包装或医疗器械产品上赋予医疗器械单一标识数据载体。
- 将UDI信息上传至国家数据库:在产品上市销售前,将产品标识和相关资讯上传至 医疗器械单一标识数据库。
- 定期更新数据库:产品标识及相关信息变化时,及时更新至国家数据库。
*注一:数据载体指的是储存、传输数位化信息的媒介或平台。
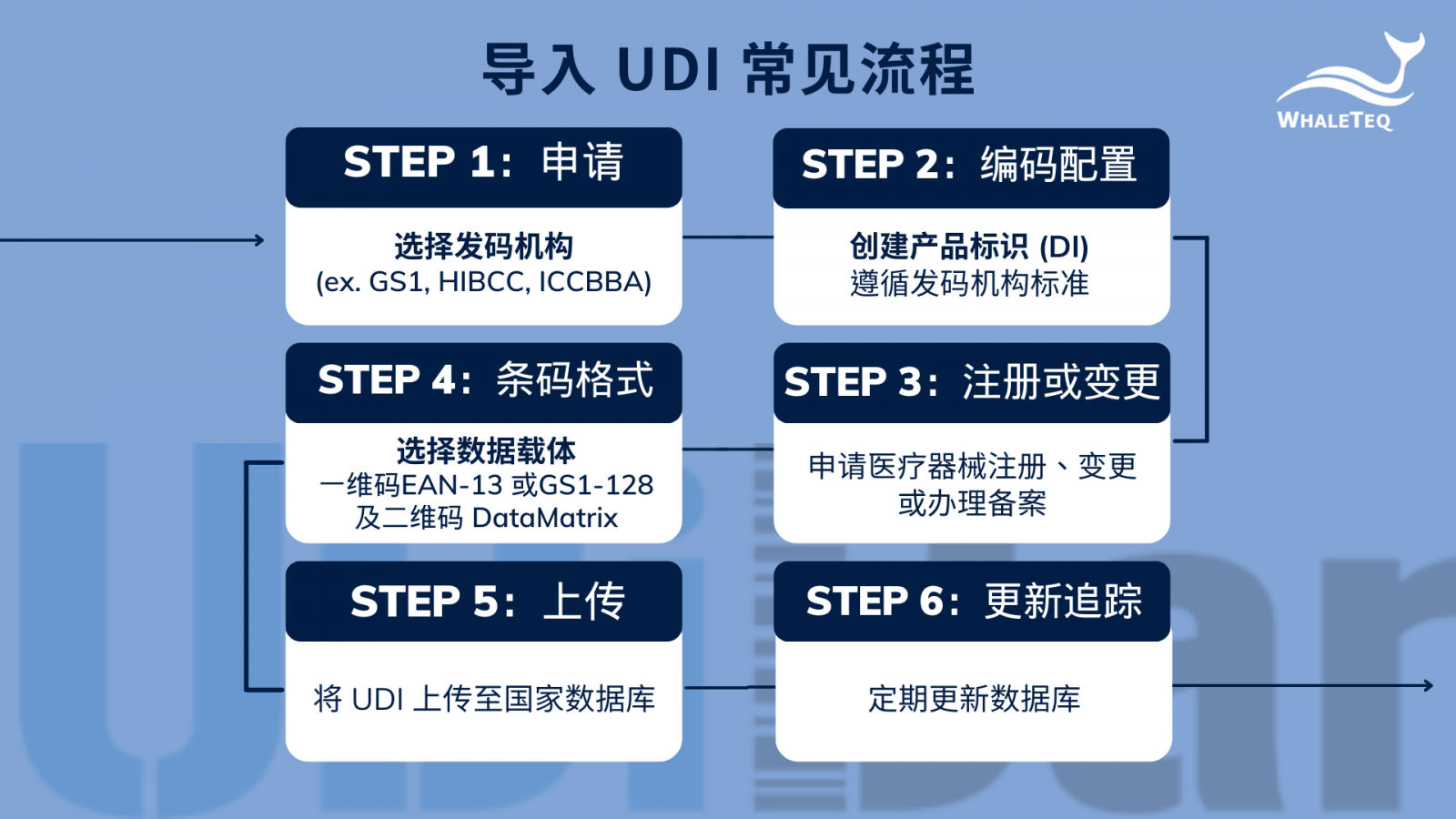
图一:导入UDI常见流程
二、导入UDI的挑战与所需资源
医疗器械唯一标识系统除固定和强制性的编码外,企业内部应自行订立一套医疗器械编码标准,并建立自己的数据库系统。反之,如果编码标准不统一、分散多种数据管理方式,将不利于后续各环节信息交换与共用,在追溯过程中要找到主责者也存在一定困难。
- 企业合规性
以一般情况来说,大企业通常会配置专业团队负责产品医疗器械单一标识的导入,这些企业具有完备的团队和经验、人力与财力等资源,他们可以在各国主管机关自主注册审核并提交DI部分(静态编码)数据。 PI部分(动态编码)可以由企业自行编码、管理;相较于大型企业,中小型制造商在资源、经验和资金较受限,在导入UDI时将面临巨大挑战。
- 人力成本
医疗器械制造商是具体实施医疗器械唯一标识的主导者,由于建置医疗器械唯一标识码需花费一定的费用,企业需自行编辑PI编码,且随着编码量增大,还存在数据储存、查询、流通、应用等问题,需要花费较大人力和资源来完成。虽然可以使用Excel表格自行保管编码数据,但通过Excel记录很容易编写错误,如:在档案传输过程中经手多个部门,造成数据错误、错漏、版本不统一等情况,为后续检查及稽核带来麻烦。
- 生产流程、设备
为了符合条码持久性与标签可读性的原则, 医疗器械制造商应具备能力生产出符合标准的生产设备、IT系统,或升级现有的设备与系统。如:生产线应具备列印单一标识的能力,同时也需要检查可读性的系统,如视像系统、扫描系统及验证系统等。
生产流程方面,制造商须考虑多部门协作的方式,因为UDI的实施范围涵盖了原料入厂及检验、产品生产、中间品控制、成品包装、储存、运输等全流程,生产和质量管理部门应配合建立操作和检验的SOP 、产品储存和运输流程,甚至包括产品注册信息的更新等。
三、应对策略
在实际导入前,可依循下列步骤,按部就班规划导入流程,帮助企业更有效率达成目标。
- 确定目标:在导入UDI前,应明确定义导入目标,如:提高使用者安全、提高生产效率、遵守法规等。明确的目标有助于改善整个导入流程。
- 寻求专业支援:UDI导入需要特定的技术知识和专业支援。考虑与UDI专家或软件供应商合作,以确保导入顺利进行并符合法规要求。
- 进行流程评估:检视现有的生产流程,确定哪些步骤需要修改以符合UDI要求。这可能涉及更改产品标签、追踪库存或修改数据管理等流程。
- 选择与生产流程相符的UDI技术:如条码扫描、RFID技术或其他自动标识技术,确保所选技术能满足需求并具有扩展性。
- 数据管理:考虑如何管理和储存UDI数据。应具备可靠的数据管理系统,以便在需要时查询和追踪数据。
- 持续监控和改进:UDI导入后,持续监控流程,检查是否存在问题或改进的机会。这有助于确保UDI的有效性和合规性。
四、解决方案
鲸扬科技研发医材专用UDI生成与标签管理系统- UDiBar ,其设计依循法规与标准,从前端的产品编码、国家数据库上传、产线生产资讯自动带入、标签设计与打印,到产品上市后的追踪管理,只需单一软件平台即可完成所有作业流程。此外, UDiBar具备权限审核控管机制,并提供软件确效报告书,符合ISO13485质量管理要求,能有效缩短导入时程、减少人员培训困扰。

图二:UDiBar产品架构图
以下依国际标准GS1规定,说明UDiBar如何实际解决UDI导入问题:
1. 编码原则
采用GS1编码体系:GS1是一个全球标准组织,提供了一套广泛使用的编码体系,用于标识产品、地点、资产等。制造商需要选择符合GS1标准的编码方式,以确保其产品的唯一标识性。
UDiBar内建产品标识(DI)检核码计算及检查功能,并可验证产品码是否重复使用,以确保每个DI的正确性与唯一性。此外,亦可定义生产资讯标识(PI),依固定资讯在前、变动资讯在后等规则自动排序,并将变动资讯自动带入标签列印,减少人因错误,亦可实现自动化生产需求。产出之UDI码完整记录于数据库中,确保PI准确且可以追溯至具体的生产过程。
2. 条码标准
采用GS1条码标准:GS1提供了一套条码标准,将UDI编码转换为可供扫描的条码。制造商应遵循GS1条码标准生成UDI条码,以确保可读性和全球通用性。
UDiBar将UDI编码转换成机器可读的条码类型。符合GS1应用辨识码标准条码GS1-128 (ISO/IEC 15417)及Data Matrix (ISO/IEC 1 6 022),以确保条码在扫描时能够正确解码并在全球通用。
使用者可在UDiBar编辑标签,包括UDI条码、文字讯息和其他必要的标识元素。标签设计应符合GS1标准,以确保一致性。所有产出标签有完整纪录,可随时查找打印纪录及对应底图,整合条码、标签设计与标签打印管理。
3. 条码质量控制
制造商应实施质量控制程序,确保生成的条码质量良好,不会出现扫描问题。这包括条码的清晰度、对比度、大小和位置。 UDiBar设计扫码检测功能,连接扫码机执行扫码,确认条码打印质量、是否可被读取,并检核条码所携带信息是否为UDiBar产出的UDI编码,以达到质量控制与数据正确性的检查。
4. 数据整合与权限分层管理
依法务、品管、制造部门职责,设定管理者和使用者权限,信息需经过管理者审查签核后方可使用,有效把关正确性。
UDiBar将所有UDI信息整合于同一数据库中,避免转换软件、跨档案复制信息时发生错误。同时,经审核的UDI信息即直接汇入UDiBar软件供标签编辑,省去手动复制与贴上的时间。
优化UDI导入流程需要计划、执行和不断改进。通过明确的目标、专业支援、技术选择和培训,中小企业可以实现UDI的有效导入,从而提高产品质量、符合法规要求并提高竞争力。